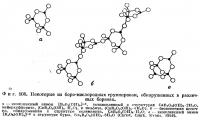
Бораты с изолированными группами BO3 или BO4
Синхалит, MgAlBO4. По величинам показателей преломления и удельному весу этот минерал настолько близок к оливину, (Mg, Fe)2SiO4, что использовавшиеся в качестве драгоценных камней образцы синхалита в течение многих десятилетий ошибочно отождествляли с этим силикатом. Столь большое сходство физических свойств является следствием изоструктурности этих двух минералов. Изолированные тетраэдры BO4 в структуре синхалита занимают те же положения, что и тетраэдры SiO4 в структуре оливина (фиг. 121) (Claringbull, Hey, 1952).
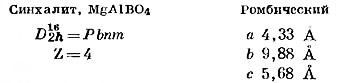
Гамбергит, Ве2ВO3(OH). Структура гамбергита в общих чертах была определена Захариазеном в 1931 году (Zachariasen, 1931). Принципиальная правильность этой структуры была позже подтверждена при детальном исследовании, проведенном Захариазеном, Плеттингером и Марецио (Zachariasen. Plettinger, Marezio, 1963). Эти авторы установили точные величины межатомных расстояний и определили положение атомов водорода.

Структура гамбергита изображена на фиг. 109 в проекции на плоскость (001), причем перпендикулярная этой плоскости ось проектирования соответствует самому короткому периоду решетки с (4,43 Å). Каждый атом кислорода участвует в образовании двух тетраэдров вокруг атомов Be, а также входит в треугольную группу, окружающую В. Каждая группа ОН связана только с двумя атомами Be. В Ве-тетраэдр входят три атома О и одна группа ОН; среднее расстояние Be — (ОН) составляет 1,633 Å. Атомы бора находятся в центрах треугольников, образованных атомами кислорода; среднее расстояние В — О равно 1,367 А. Плоскости треугольников В03 на фиг. 109 перпендикулярны плоскости чертежа.
На фиг. 109 показаны гидроксильные группы, каждая из которых состоит из атома водорода, связанного с одним атомом кислорода. Однако в действительности дело обстоит сложнее: имеется также и более слабая водородная связь со вторым атомом кислорода. Рентгенографические исследования подтвердили данные инфракрасной спектроскопии (Verg-noux, Ginoves, 1955), согласно которым в структуре гамбергита атомы водорода несколько смещены (приблизительно на 0,3 Å) от прямой линии, соединяющей атомы кислорода, связанные водородной связью.
Другой интересной особенностью структуры гамбергита является весьма малая амплитуда тепловых смещений атомов, что хорошо согласуется с высокой твердостью этого минерала. С помощью метода Брэггаудалось с весьма большой точностью теоретически вычислить величины показателей преломления для различных направлений в кристаллах гамбергита. Вычисленные значения Ng, Nm и Np равны 1,638. 1,590 и 1,557, а соответствующие экспериментальные величины составляют 1,631, 1,591 и 1,560.
Бораты со сложными боро-кислородными группами
В структурах, которые будут рассмотрены в этом разделе, бор находится одновременно как в треугольной, так и в тетраэдрической координации.
Колеманит, СаВ3O4(OH)3·H2O. Структура этого минерала определена Кристом, Кларком и Эвансом (Christ, Clark, Evans, 1958).

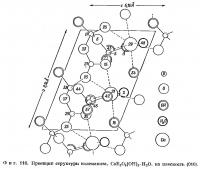
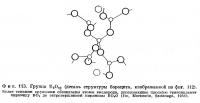
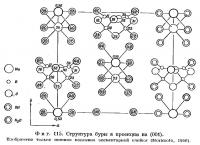
Расположение атомов в нижней половине элементарной ячейки колеманита показано на фиг. 110 в проекции на (010). Эта половина связана с вышележащей осью 21. Вдоль [100] тянутся бесконечные цепочки из связанных между собой В03-треугольииков и В04-тетраэдров. Такие цепочки обнаружены также и в других боратах. Одно звено цепочки имеет состав [B3O4(OH)4]-2 и построено из двух тетраэдров В04 и одного треугольника В03, которые соединяются общими вершинами, образуя замкнутое кольцо (фиг. 111). Между цепочками находятся атомы кальция и молекулы воды. Каждый атом кальция расположен в середине полиэдра неправильной формы, образованного четырьмя кислородами (или гидроксильными группами) и одной молекулой воды, со средним расстоянием от центрального атома 2,42 Å. Кроме того, имеются еще два несколько более удаленных атома кислорода, для которых расстояние Са — О составляет 2,52 Å. Атомы кальция связывают между собой отдельные боро-кислородные цепочки в слои, параллельные (010). Эти атомы вместе с гидроксильными группами и молекулами воды связывают соседние слои друг с другом. Среднее расстояние В — О в тетраэдрах равно 1,48 Å, а в треугольниках — 1,37 Å.
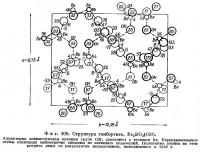
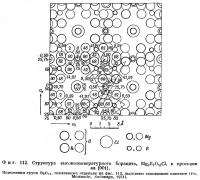
Борацит, Mg3B7O13Cl. Этот минерал имеет низкотемпературную и высокотемпературную модификации с точкой перехода при 265°. Переход обратим и сопровождается лишь весьма небольшим изменением периодов решетки. Поэтому рентгенограммы порошка обеих модификации почти одинаковы. Кристаллы высокотемпературного борацита — кубические; при температуре ниже точки перехода они превращаются в полисинтетические двойники псевдокубических кристаллов низкотемпературной модификации. Структура минерала изучена Ито, Моримото и Саданагой (Ito. Morimoto, Sadanaga, 1951) (фиг. 112 и 113).
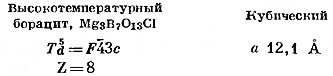
Главное затруднение при изображении проекции структуры связано с большими размерами и высокой симметрией кубической ячейки и соответственно с большими количествами катионов каждого сорта. В случае борацита атомы кислорода, находящиеся в общих положениях, имеют кратность 96. Основные черты структуры могут быть показаны на ее фрагменте, изображенном на фиг. 113. Основу структуры борацита составляет каркас из групп ВO4 и ВO3, в который вкраплены ионы магния и хлора. Из 56 атомов бора, содержащихся в элементарной ячейке, 24 расположены в центрах тетраэдрических групп, а 32 атома, находящихся на тройных осях,— в центрах почти копланарных треугольных групп ВO3. Тетраэдры и треугольники связаны между собой общими вершинами. Атомы магния находятся в окружении четырех атомов кислорода и двух атомов хлора.
Вышеупомянутые авторы установили, что низкотемпературный бора цит имеет ромбическую элементарную ячейку с параметрами a = b = 8,54 Å, c = 12,07 Å, Z = 4. Для него характерна резко выраженная кубическая псевдосимметрия. При переходе одной модификации в другую каркас из групп ВO3 и ВO4 не разрушается. Атомы хлора при высоких температурах колеблются между двумя кристаллографически эквивалентными положениями, а в низкотемпературной модификации эти атомы фиксированы в одном или другом из возможных положений. Изменение характера распределения атомов хлора и составляет сущность полиморфного превращения.
Бура, Na2B4O5(OH)·8Н2O. Часто употребляемая формула этого соединения Na2B407 ЮН20 в соответствии с данными Моримото (Morimoto. 1956) должна быть преобразована в указанную выше.
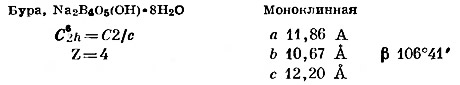
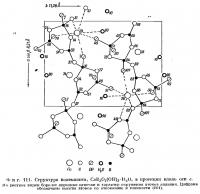
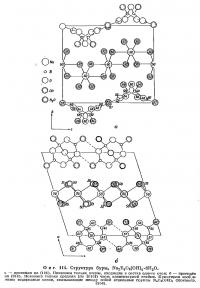
Структура буры изображена на фиг. 114 и 115. Строение боро-кислородного комплекса лучше всего иллюстрируется проекцией на плоскость (010) (фиг. 114, б). Эти комплексы состоят из двух тетраэдров и двух треугольников, в центрах которых находятся атомы бора, а в вершинах — О и ОН. Состав каждого комплекса выражается формулой В4O5(ОН)4; они. по-видимому, соединяются между собой связями О — Н — О в бесконечные цепочки, параллельные оси с. Октаэдрические группы из молекул воды вокруг атомов натрия также образуют цепочки, протягивающиеся вдоль оси b. Если взглянуть вдоль [001] (т. е. вдоль цепочек), будет казаться, что они расположены в шахматном порядке, так как грань с центрирована. Цепочки обоих типов валентнонасыщены и нейтральны. Между ними действуют только слабые силы полярного взаимодействия между группами ОН. Этим обусловлена чрезвычайно низкая твердость буры — от 2 до 2,5 по шкале Мооса. Направления совершенной спайности по {100} и хорошей спайности по {110}, как и следовало ожидать, параллельны цепочкам.
Средние расстояния В — О в тетраэдрах равны 1,48 Å, а в треугольниках — 1,36 Å. Эти величины очень близки к соответствующим межатомным расстояниям в других соединениях бора.
Литература по структурам минералов, не описанных в тексте

Примечания
1. Одним из исключений является стишовит. См. Chao Е. С. Т., Fahey J. J., Citter J., Milton I. J., Journ. Geophys. Res., 62, 419, 1962.